报告
2018年我国医疗器械不良事件监测现状分析和监管制度改革
检索正文关键字
报告目录
-
一 我国医疗器械不良事件监测工作现状
- (一)我国不良事件监测工作的起步和发展
- (二)医疗器械不良事件监测工作有序推进
- 1.不良事件报告数量快速增长
- 2.不良事件报告县级覆盖率保持稳定
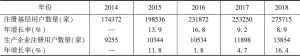
- 3.不良事件监测系统注册基层用户数量增长
- 4.不良事件监测风险防控能力提升
- (三)生产企业医疗器械不良事件监测工作中存在的不足
- 1.对不良事件监测存在认知偏差
- 2.监测主体责任未落实到位
- 3.监测工作能力欠缺
-
二 医疗器械不良事件监测制度新要求
- (一)办法修订背景
- (二)不良事件监测制度的新要求
- 1.明确了持有人定义和主体责任
- 2.明确了持有人义务
- 3.明确持有人不良事件报告与评价的责任
- 4.明确持有人重点监测责任
- 5.明确持有人风险控制责任
- 6.明确了持有人再评价责任
- 7.明确持有人法律责任
- 8.明确了境外持有人和其境内代理人的责任
- 9.明确创新器械持有人的工作要求
- 10.强化对监测工作的监管要求
-
三 正确认识医疗器械不良事件监测工作
- (一)不良事件监测是国际实践公认有效的风险管理手段
- (二)不良事件监测是强化产品全生命周期管理的重要手段
- (三)生产企业开展不良事件监测的意义
- 1.监测工作为技术创新保驾护航
- 2.监测工作推动产品高质量可持续发展
- 3.监测工作提升企业产品竞争力
-
四 推动落实好不良事件监测各项工作
- (一)制定发布《办法》配套指导原则
- (二)组织开展宣贯培训
- (三)完善监测网络信息化建设
- (四)组织开展监督检查
- (五)加强能力建设,提升监测专业化水平
查看更多>>>