报告
中国二类新药发展现状及发展趋势
摘要
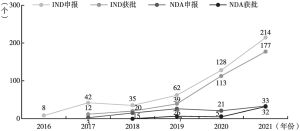
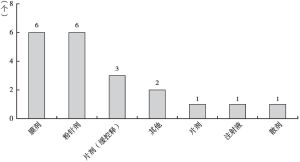
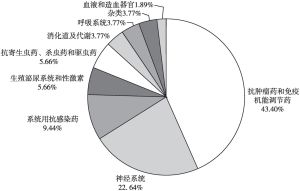
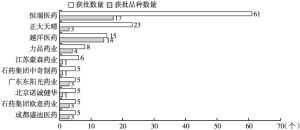
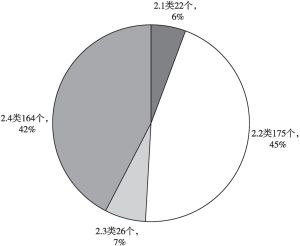
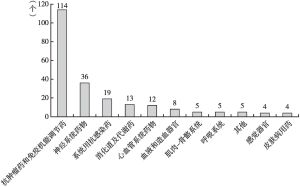
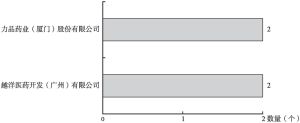
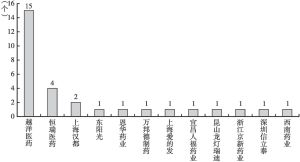
2010年,FDA通过505(b)(2)路径获批的新药数量首次超过505(b)(1)路径获批的新药,自此505(b)(2)路径新药成为新药研发主力,获批的新药数量持续领先。2016年,中国开始重视505(b)(2)新药,国家食品药品监督管理总局发布了化学药品注册分类改革工作方案,诞生了二类新药(境内外均未上市的改良型新药)。本文通过分析2016~2021年国内企业二类新药NDA申请和获批情况、IND申请和获批情况得出,5年内共有21家企业26个品种44个产品获批NDA,151家企业188个品种361个产品获批IND,主要分布在江苏省、广东省以及北京市等地区,其中包括恒瑞医药、正大天晴等规模以上药企和越洋医药、力品药业等创新型药企。二类新药获批数量呈现逐年递增趋势,2021年数量最多,其中获批上市批准32个,临床试验批准177个。二类新药的开发主要集中在2.2类(改剂型)和2.4类(改适应证),约占80%以上,剂型则以片剂为主。
检索正文关键字
报告目录
-
一 二类新药发展意义
- (一)满足医患双方的需要
- (二)减小企业新药开发压力
- (三)符合中国医药产业发展策略
-
二 二类新药发展现状
- (一)国内外发展概述
- 1.中国二类新药与美国NDA[505(b)(2)]的异同与发展概括
- 2.二类新药发展概述
- (二)获批NDA上市产品发展现状
- 1.产品统计
- 2.产品分析
- 3.企业分析
- 4.销售情况
- (三)获批IND研发产品发展现状
- 1.不同类别的发展现状
- 2.不同适应证的发展情况
- 3.不同剂型的发展情况
- 4.不同区域的发展情况
- (一)国内外发展概述
-
三 二类新药发展趋势
- (一)以临床优势为导向开发二类新药
- (二)以创新技术为核心开发二类新药
- (三)差异化布局,多方向探索
- (四)改剂型、新适应证成为发展主流
- (五)区域竞争加剧,政策持续发力
-
四 展望和建议
- (一)加强国内新药国际化
- (二)大力发展二类新药
- (三)搭建研发及产业化平台
- (四)科技专项扶持
- (五)鼓励传统药企和创新药企合作开发
- (六)鼓励产学研医合作
- (七)借鉴FDA制定临床开发策略
相关文献
查看更多>>>