报告
美国医疗人工智能发展研究
摘要
人工智能的发展对人类社会造成了巨大的影响,其应用领域覆盖包括医疗在内的各行各业。美国作为人工智能领域的领跑者,非常重视人工智能产业发展;不仅成立了专门的管理和研究机构,制定了一系列鼓励医疗人工智能发展的政策,而且对医疗人工智能产品的审批、准入和市场监管做了适应性调整,完成审批了一批以人工智能为核心技术的医疗器械软件(SaMD)。这些举措对于我国医疗人工智能发展具有借鉴意义。本文梳理了美国四年来(2016~2019)发布的(医疗)人工智能的发展政策,重点解读美国医疗器械市场准入和监管政策为了鼓励医疗器械软件(SaMD)创新而做的更新。本文对美国食品药品监督管理局(FDA)已批准上市的医疗人工智能产品做整理和归纳,介绍具有代表性的人工智能上市产品的技术优势、临床价值,为国内开展医疗人工智能产品研发提供参考。
作者
刘智 ,北京大学肿瘤医院,主要研究方向为卫生政策、医院管理、医疗人工智能和信息化。
汪怡雯 ,北京大学生命科学学院,主要研究方向为人工智能技术应用于医疗和生命科学领域的法律与政策背景。
李硕 ,北京大学药学院,博士,主要研究方向为人工智能在医疗和生命科学领域政策研究。
宋博强 ,北京大学智慧城市研究中心博士后,主要研究方向为医学大数据与人工智能。
谢沂伯 ,北京医院信息中心计算机室主任,高级工程师,主要研究方向为医院信息互联互通及医疗人工智能标准规范。
李书芳 ,北京邮电大学教授,博士生导师,中国无线与移动通信委员会副主任委员,IEEE高级会员,主要研究方向为人工智能大数据。
Liu Zhi
Wang Yiwen
Li Shuo
Song Boqiang
Xie Yibo
Li Shufang
检索正文关键字
报告目录
-
一 美国医疗人工智能政策
- 1.《国家人工智能研究和发展战略规划》
- 2.《为人工智能的未来做好准备》
- 3.国家机器人计划2.0
- 4.《人工智能、自动化与经济学报告》
- 5.《人工智能未来法案》
- 6.《科学和技术要点——特朗普执政首年回顾》
- 7.美国人工智能倡议
- 8.《科学和技术要点——特朗普执政第二年回顾》
- 9.《国家人工智能研发战略规划:2019年更新》
-
二 美国医疗人工智能产品的市场监管
- (一)医疗人工智能产品市场监管概况
- (二)医疗器械软件传统管理方法:遵循医疗器械管理规范
- 1.医疗器械软件(SaMD)概念
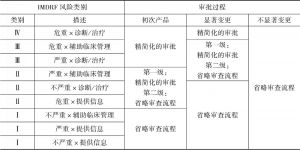
- 2.传统医疗器械的风险评级及市场准入
- 3.传统医疗器械的上市后监管
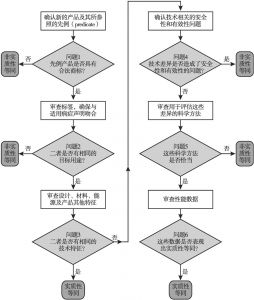
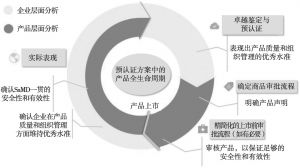
- (三)SaMD管理的新方案:预认证方案(The Software Pre-certification Program)
- 1.预认证方案产生的背景
- 2.预认证方案内在逻辑
- 3.预认证方案特点
- 4.预认证方案流程
- 5.试点、进展与效果
-
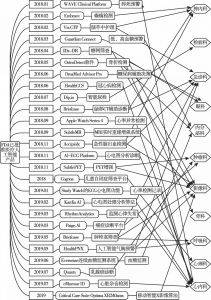
三 FDA已批准医疗人工智能产品
- (一)AI-ECG Platform
- 1.产品技术介绍
- 2.FDA批准路径
- 3.应用场景
- 4.临床价值
- 5.商业化特点
- 6.同类产品的比较
- (二)Briefcase
- 1.产品技术
- 2.FDA批准路径
- 3.应用场景
- 4.临床价值
- 5.商业化特点
- 6.同类产品的比较
- (三)SubtlePET
- 1.产品技术
- 2.FDA批准路径
- 3.应用场景
- 4.临床价值
- 5.商业化特点
- 6.同类产品的比较
- (四)GuardianTM连续血糖监测(CGM)系统[GuardianTM Connect Continuous Glucose Monitoring (CGM) system]
- 1.产品技术
- 2.FDA批准路径
- 3.应用场景
- 4.临床价值
- 5.同类产品的比较及产品市场分析
- (一)AI-ECG Platform
- 四 总结
相关文献
查看更多>>>