报告
2019年我国医疗器械标记合规性问题分析报告
摘要
统计发现,在产品抽查中发现的标识标签及说明书不合格的产品主要是有源类医疗器械,极少数一次性使用无菌产品也有类似问题,植入类医疗器械没有此类问题。在产品召回中发现的医疗器械标记不合规产品中,有源类医疗器械不合规问题尤为集中。2017~2019年,有源类医疗器械因标记不符合产品要求导致的产品召回数占该类召回总数的比例分别为100%、98.59%和78.26%。在细致分析导致上述合规性问题的原因的基础上,本文提出三条建议:①全面推行医疗器械唯一标识(UDI)系统;②提高有关医疗器械标记标准的通用性;③加强医疗器械设计开发和生产过程控制。
检索正文关键字
报告目录
-
一 我国医疗器械制造商提供信息的实施状况
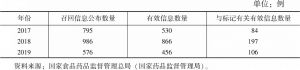
- (一)产品抽查发现的有关标记的合规性问题
- (二)产品召回发现的有关标记的合规性问题
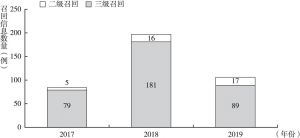
- 1.标记不合规产品的召回分级
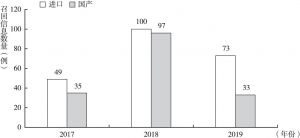
- 2.国产医疗器械与进口医疗器械召回数量对比
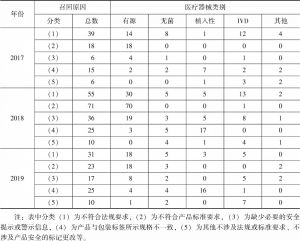
- 3.标记不合规导致召回的具体情形
-
二 医疗器械标记不合规问题解决路径
- (一)全面推行医疗器械唯一标识(UDI)系统
- (二)提高有关医疗器械标记标准的通用性
- (三)加强医疗器械设计开发和生产过程控制
相关文献
查看更多>>>