报告
我国创新医疗器械特别审批政策现状和发展
检索正文关键字
报告目录
- 一 创新医疗器械特别审批程序
-
二 医疗器械优先审批程序
- (一)优先审批的范围
- (二)优先审批程序
- (三)罕见病、老年人特有和多发疾病、临床急需等情况的认定
- (四)与医疗器械应急审批程序、创新医疗器械特别审批程序的关系
-
三 创新医疗器械审查和各地方政策概况
- (一)创新审查总体情况
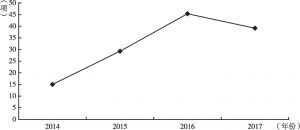
- 1.创新医疗器械审批申请情况
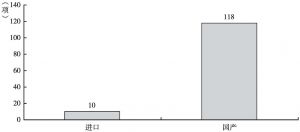
- 2.创新项目有效填补国内空白
- 3.部分批准注册创新医疗器械概况
- (二)部分省局发布的创新医疗器械程序
- 1.《北京市医疗器械快速审评审批办法(试行)》
- 2.《广东省第二类创新医疗器械特别审批程序(试行)》
- 3.《山东省创新医疗器械特别审批办法》
- (一)创新审查总体情况
- 四 下一步举措
相关文献
查看更多>>>